联系热线
近日,中国医疗器械凭NMPA认证可通过马来西亚"验证通道"30天极速获批,而马来西亚IVD产品也可经中国"绿色通道"60天准入中国市场。并且,中国省级药品监管部门颁发的II类IVD证书首次被纳入认可范围。
根据马来西亚医疗器械管理局(MDA)发布的公告,该试点第一阶段将持续至2025年9月30日,为IVD(体外诊断)企业提供了一个仅2个月的宝贵窗口期。这一突破性政策将极大简化中国IVD产品进入马来西亚市场的审批流程,从以往半年以上的注册周期缩短至仅30个工作日。

对于想开拓东南亚市场的IVD企业来说,手上拥有NMPA二/三类注册证的IVD企业,可以跳过重复临床、跳过冗长审评,直接申请马来西亚市场准入。
审批时间大幅缩短:从传统流程需要6-24个月缩短至30个工作日。
成本显著降低:免去重复临床和检测环节,企业可节省约90%的合规成本。
流程极大简化:设计、材料、适应症无需改动即可原样通关。
值得注意的是,目前该互认协议仅适用于IVD产品,不包括普通医疗器械。马来西亚MDA官方已确认这一范围限制,但未来可能会扩展至其他医疗器械类别。协议实施后,中国NMPA的监管决定将获得与欧盟、美国FDA、澳大利亚TGA等传统权威机构同等的认可地位。
根据马来西亚MDA发布的《马来西亚-中国医疗器械监管互认计划的实施(试点第一阶段:2025年7月30日至9月30日)》公告,申请企业需满足以下核心要求:
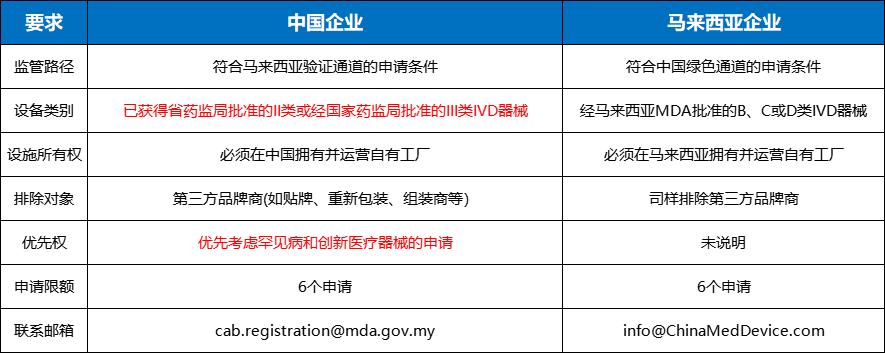
资格要求
特别提醒:企业应充分利用这2个月的试点窗口期,因为试点结束后政策可能会有调整。早提交的企业将享受"先到先审"的优势。如有IVD产品注册等需求,欢迎咨询创京检测。
注册流程
指定授权代表 (AR): 中国制造商必须指定一个持有有效MDA机构许可证的马来西亚当地授权代表(AR)。
预审文件提交:AR向MDA提交上市前文件包进行初步资格筛选。提交邮箱:cab.registration@mda.gov.my
CAB技术评估: MDA在确认资格后,将指派合格评定机构(CAB)进行验证评估。
评估报告出具: CAB出具评估报告后,AR通过MeDC@St™系统提交正式的医疗器械注册申请。
正式注册申请: MDA评估申请并颁发注册证书。
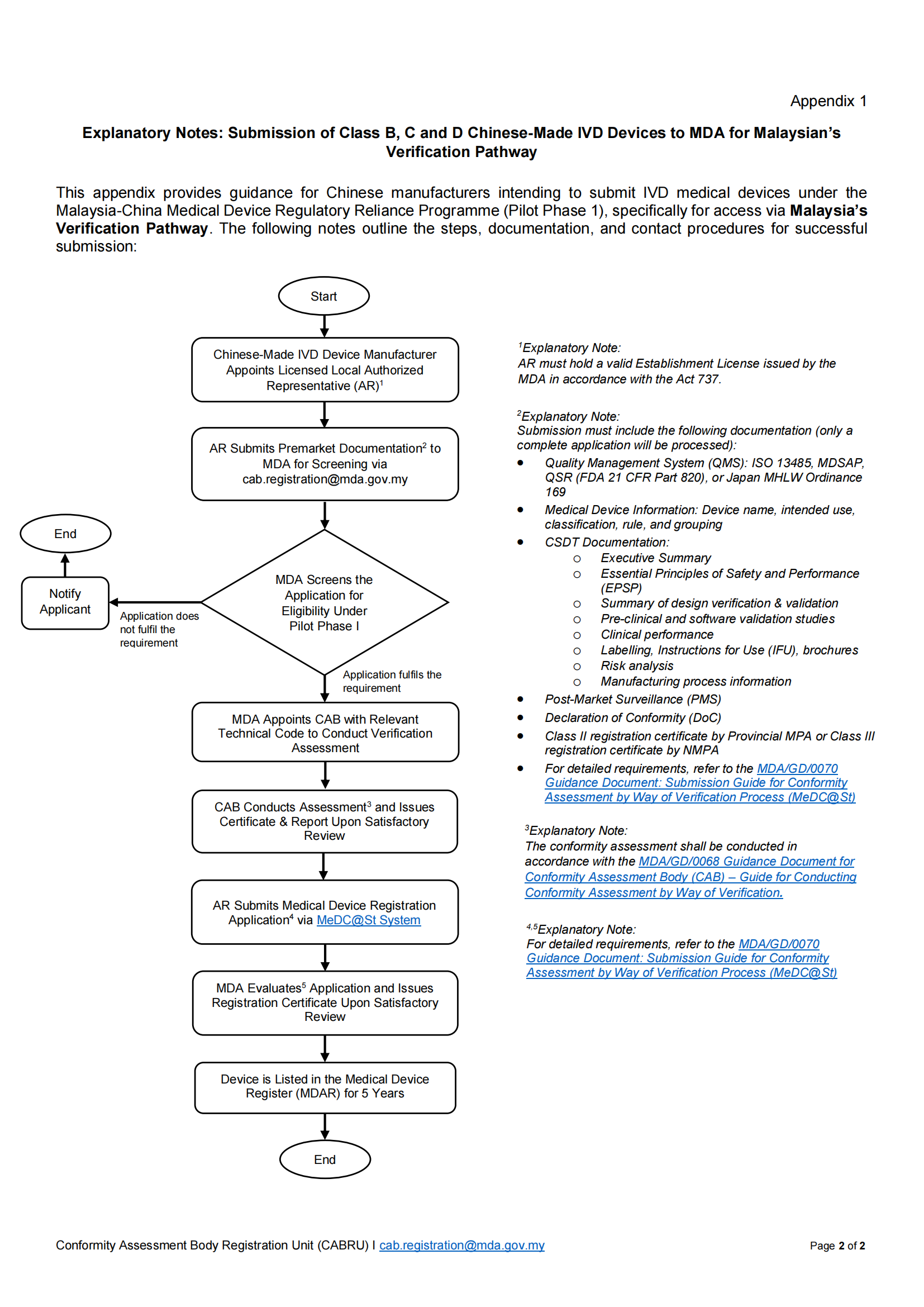
注册申报资料要求
质量管理体系(QMS):ISO 13485、MDSAP、QSR(美国FDA 21 CFR第 820部分)或日本MHLW Ordinance 169
医疗器械信息:器械名称、预期用途、分类、适用规则及分组
CSDT 技术文档:
– 执行摘要
– 安全与性能基本原则(EPSP)
– 设计验证与确认摘要
– 临床前及软件验证研究
– 临床性能数据
– 标签、使用说明书(IFU)及宣传册
– 风险分析文件
– 生产工艺信息
上市后监测(PMS)计划
符合性声明(DoC)
中国省级药监局签发的第二类注册证书或国家药监局(NMPA)签发的第三类注册证书
省药监局II类注册证书或国家药监局III类注册证书
长期来看,这一互认机制可能推动形成全球IVD监管新秩序,改变长期以来由欧美主导的医疗器械国际规则体系,为中国乃至发展中国家的医疗产品全球化创造更公平的环境。监管互认的时代已经到来,这不仅是一种行政程序的简化,更是中国医疗器械产业国际竞争力提升的鲜明标志。
关于创京检测
上海创京检测技术有限公司成⽴于2018年 , 是⼀家专业的第三⽅医疗器械检验检测公司,公司拥有多项权威资 质认证,已获得国家CNAS和CMA双C资质,在⾏业内具备高度公信力。
在检测能力方面,公司检测范围广泛,涵盖EMC电磁兼容、安全性能测试、环境可靠性、软件测试、体外诊断(IVD)等各类医疗器械的注册检测和咨询等。出具权威资质的检验检测报告,已获得国家药监局 、省药监局 、审评中⼼的认可,为医疗器械在性能、安全性、有效性等⽅⾯把关。
创京检测严格按照ISO/IEC17025打造实验室管理体系。公司拥有独⽴核⼼实验室:10⽶法电磁兼容实验室、3⽶法电磁发射半电波暗室、3⽶法全电波暗室、电磁⼲扰屏蔽室、静电测试屏蔽室、电磁⼲扰抗扰度屏蔽室、电⽓安全实验室、可靠性实验室、软件测试实验室、振动运输实验室、光学实验室、⾼频⼿术设备检测实验室、超声设备检测实验室。可随时迅速响应各⾏业客⼾在各领域的不同需求,提供近距离、本地化的专业服务。