联系热线
1月5日,国家药监局官网发布公告显示,按照《医疗器械监督管理条例》《医疗器械分类目录动态调整工作程序》有关要求,结合医疗器械产业发展和监管工作实际,国家药监局决定对《医疗器械分类目录》部分内容进行调整。
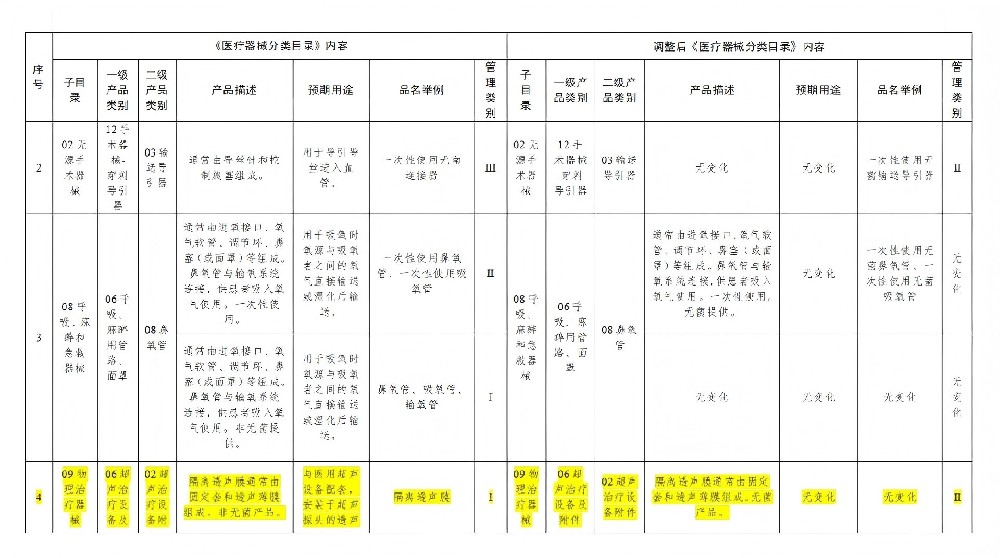
此次调整涉及无源手术器械、物理治疗器械、口腔科器械、无源植入器械等10个子目录的31类产品,调整内容包括产品描述、预期用途、品名举例,部分产品的管理类别同时调整。例如,输送导引器的品名举例由“一次性使用无菌连接器”调整为“一次性使用无菌输送导引器”,管理类别由第三类降低为第二类;超声治疗设备附件的产品描述在原有非无菌产品的基础上增加了无菌产品的描述,非无菌产品的管理类别依然为第一类,无菌产品的管理类别为第二类。
管理类别下调(降低监管强度)
这类调整主要针对一些技术成熟、临床应用经验丰富、风险认知更清晰的产品,使其监管级别与当前风险水平更匹配,可以减轻企业合规负担。
具体示例:手动轮椅车从Ⅱ类调整为I类管理。
新增及明确创新医疗器械
为近年来涌现的创新技术产品明确分类,使其纳入规范的监管体系,支持创新产品上市。
具体示例:在“闭合夹”中增加了“可降解镁金属闭合夹”;新增了“肌腱修复补片”、“可吸收肩袖修复隔离膜”、“中耳通气管”等细分品类。
管理类别上调(加强监管)
对个别产品因风险认知变化或技术发展,适当提升了监管级别,以确保安全。
具体示例:隔离透声膜(无菌产品)从I类调整为Ⅱ类。
公告全文
一、调整内容
对31类医疗器械涉及《医疗器械分类目录》内容进行调整,具体调整内容见附件。
二、实施要求
(一)自本公告发布之日起,药品监督管理部门依据《医疗器械注册与备案管理办法》《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》《关于第一类医疗器械备案有关事项的公告》等,按照调整后的类别受理医疗器械注册申请或者办理备案。
对于已受理尚未完成注册审批(包括首次注册和延续注册)的医疗器械,药品监督管理部门继续按照原受理类别审评审批,准予注册的,核发医疗器械注册证,并在注册证备注栏注明调整后的产品管理类别。
对于已注册的医疗器械,其管理类别由第三类调整为第二类的,医疗器械注册证在有效期内继续有效。如需延续的,注册人应当在医疗器械注册证有效期届满6个月前,按照改变后的类别向相应药品监督管理部门申请延续注册,准予延续注册的,按照调整后的产品管理类别核发医疗器械注册证。
对于已注册的医疗器械,其管理类别由第二类调整为第一类的,医疗器械注册证在有效期内继续有效。注册证到期前,注册人应当向相应部门办理产品备案。
医疗器械注册证有效期内发生注册变更的,注册人应当向原注册部门申请变更注册。如原注册证未按照原《医疗器械分类目录》核发,本公告涉及产品的变更注册文件备注栏中应当注明公告实施后的产品管理类别。
(二)各级药品监督管理部门要加强《医疗器械分类目录》内容调整的宣贯培训,切实做好相关产品审评审批、备案和上市后监管工作。
国家药监局
2025年12月30日